深度!一文读懂间充质干细胞外泌体与疾病的治疗


近年来,多项临床前研究证明了间充质干细胞外泌体在疾病治疗领域的潜力,并且目前有多项关于间充质干细胞外泌体在各种疾病中的治疗应用的临床研究正在进行,这些临床研究包含了免疫性疾病、神经系统疾病、心血管疾病和肿瘤等。
今天我们就一起来看看间充质干细胞外泌体到底能治疗哪些疾病?它又是如何在疾病治疗中发挥作用的?
间充质干细胞外泌体:包含丰富的活性物质
间充质干细胞具有调节免疫细胞活性和刺激组织再生的能力,这使得它们在多种疾病治疗中发挥着越来越重要的作用。而其治疗作用主要通过两种方式实现:直接的介导作用和通过可溶性因子的释放诱导疾病环境的改变[1]。这些可溶性因子被释放时,会被包裹在跟细胞膜类似的膜结构中形成囊泡,这在一方面保护了这些因子在胞外环境中能够稳定存在并保有活性,另一方面这种膜结构容易与其他细胞的细胞膜相融合,促进这些诱导因子对其他细胞的调控。


图来自参考文献18
这些囊泡结构根据其大小被分为微泡(直径为 0.1–1 mm)和外泌体(直径为50–150 nm )等[2],其中外泌体这类纳米级别的囊泡包含了细胞因子、生长因子、信号脂质、信使RNA(mRNA)和非编码RNA(miRNA)等多种调节性因子[3],在间充质干细胞调控周围环境中的其他细胞过程中发挥了重要的作用[4]。并且间充质干细胞来源的外泌体能够携带具有治疗作用的药物等到达靶细胞[5],而纳米级别的外泌体在注入后更容易到达受损组织区域,并且拥有低免疫原性和至瘤性等优点,因此引起了广泛的关注。


外泌体使免疫系统恢复平衡
免疫性疾病是免疫系统失去平衡引起的疾病,患者的免疫系统会攻击自身机体成分从而损伤正常的组织和细胞。而间充质干细胞外泌体能够抑制效应T细胞,巨噬细胞[7]和NK细胞等免疫细胞的激活,并且促进调节性T细胞[8],耐受性树突细胞[9]抑炎型(M2)巨噬细胞[10]等调节型免疫细胞的分化和增殖,从而促进免疫系统恢复到平衡的状态。
移植物抗宿主病(GVHD)是骨髓移植的严重并发症,发生率为30%-45%,是移植后死亡的主要原因。GVHD患者胃肠道,皮肤及肝脏会受到严重损伤。发表在《nature》杂志的一篇研究发现,给GVDH患者注入了间充质干细胞来源的外泌体后,患者体内释放炎症因子的免疫细胞的数量明显减少,患者皮肤的受损,腹泻等情况明显改善[11]。
慢性GVHD患者还会出现干眼症,视力受损,吞咽困难和呼吸困难等症状,其中干眼症发生率很高,并且能够反映疾病的进程。2019年开始的一项临床研究(NCT)正在评估间充质干细胞外泌体对GVHD导致干眼症等症状的治疗作用。

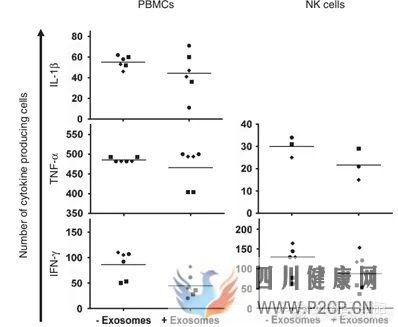


(图片来自参考文献11)
I型糖尿病也是一种发生率较高的自身免疫疾病,免疫系统异常激活后攻击胰腺 β细胞,导致胰岛素产量的急剧下降和葡萄糖代谢的紊乱。目前没有有效的治疗方法,患者需要每天注射胰岛素来维持正常的血糖水平[12]。发表在《 J Cell Biochem》的研究发现,间充质干细胞外泌体的注入促进了I型糖尿病疾病模型小鼠脾脏中的免疫抑制性T细胞(Treg)的增殖,并且促进了胰岛的再生[13]。一项临床研究(NCT)正在评估间充质干细胞外泌体对I型糖尿病的治疗作用。
外泌体改善心血管功能
缺血性心脏病即冠心病发病率极高的心血管疾病,也是导致中国人死亡的主要原因之一。发表在《BioMed Res》杂志的一篇研究发现,间充质干细胞外泌体的注入抑制了缺血性心脏病疾病模型大鼠的心脏的纤维化和炎症反应,并且明显改善了心脏的功能[14]。而伊斯法罕医科大学的最新临床研究(NCT)正在探索携带miR-124的间充质干细胞外泌体对缺血性心脏病的治疗作用。

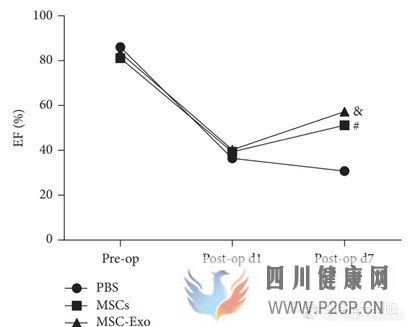

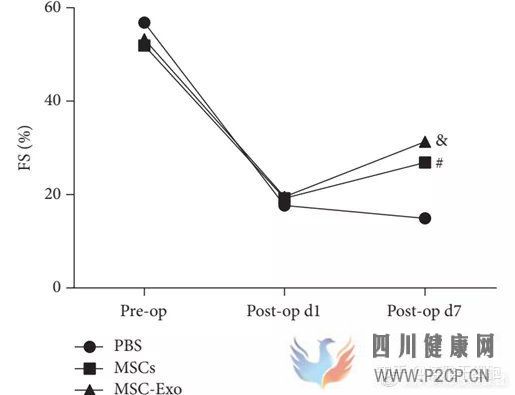
(EF:左心室射血分数 FS:左心室缩短分数 图来自参考文献14)
外泌体抑制肿瘤生长
发表在《science signaling》杂志的一篇研究发现,携带miR-23b的间充质干细胞外泌体能够抑制转移性癌细胞的增殖,从而促进转移性乳腺癌进入休眠期[15]。另一篇发表在《cancer》杂志的研究证明,携带紫杉醇的间充质干细胞外泌体能够直接抑制肿瘤的生长,并且将紫杉醇的有效浓度降低了1000倍[16]。在一项临床试验中(NCT),含有靶向致癌性KrasG12D突变的siRNA的间充质干细胞外泌体正被用于治疗胰腺癌 。


(图片来自参考文献16)
外泌体提高新冠肺炎治疗效率
目前,新冠肺炎变成了对全球公共卫生和世界经济的最大威胁,急需实用的预防和治疗的方法。而大小约为100 nm的外泌体可通过雾化吸入应用,同时保持其免疫调节功能 ,并且其膜结构能够携带具有生物活性的分子和药物直接进入肺部,提高治疗效率[17]。目前有四项临床研究正在探索间充质干细胞外泌体对新冠肺炎的治疗作用。


外泌体与抗衰养颜
除了疾病的治疗,越来越的研究证明间充质干细胞外泌体具有抗衰老等作用。皮肤由表皮层和真皮层构成,因为表皮层中没有血管,因此需要表皮层与真皮层之间的胶原纤维将氧气和营养物质运送表皮层。胶原纤维由胶原蛋白等组成,除了输送营养物质,胶原纤维还赋予皮肤支撑和弹性[19],而皮肤的衰老伴随着胶原蛋白的大量流失。
发表在BBRC杂志的一篇研究发现,间充质干细胞外泌促进了人类皮肤成纤维细胞(HDF)的迁移和胶原蛋白的合成。他们还用人的皮肤组织评估了外泌体渗透皮肤的能力,发现外泌体在3小时内会透过角质层到达表皮层的外沿,18小时内会逐步进入表皮内部。在用外泌体治疗后的第三天,人的皮肤组织中胶原蛋白和弹性蛋白的表达量由了明显的提升[20]。


(外泌体能够渗透表皮层)




胶原蛋白和弹力蛋白的表达升高,图片来自参考文献20
外泌体的未来不容小觑


图来自参考文献18
间充质干细胞外泌体可以保护生物活性分子免受细胞外降解并以高度特异性的方式将其递送至受体细胞,这使得间充质干细胞外泌体成为了癌症和潜在再生医学的理想递送系统 ,而且越来越多的研究证明了其安全性和有效性,相信间充质干细胞外泌体会在更多复杂的疾病治疗和美容等领域发挥其作用。
参考文献:
1. Yagi, H.; Soto-Gutierrez, A.; Parekkadan, B.; Kitagawa, Y.; Tompkins, R.G.; Kobayashi, N.; Yarmush, M.L. Mesenchymal stem Cells: Mechanisms of immunomodulation and homing. Cell Transplant. 2010, 19, 667–679
https://doi.org/10.3727/096368910X508762
2. El Andaloussi, S.; Mäger, I.; Breakefield, X.O.; Wood, M.J.A. Extracellular vesicles: Biology and emerging therapeutic opportunities.Nat. Rev. Drug Discov. 2013, 12, 347–357 https://doi.org/10.1038/nrd3978
3. Toh, W.; Lai, R.C.; Hui, J.H.P.; Lim, S.K. MSC exosome as a cell-free MSC therapy for cartilage regeneration: Implications for osteoarthritis treatment. Semin. Cell Dev. Biol. 2017, 67, 56–64. https://doi.org/10.1016/j.semcdb.2016.11.008
4. Heldring N, Mager I, Wood MJ, Le Blanc K, Andaloussi SE. Therapeutic potential of multipotent mesenchymal stromal cells and their extracellular vesicles. Hum Gene Ther. 2015;26:506–17. https://doi.org/10.1089/hum.2015.072
5. Bagno L, Hatzistergos KE, Balkan W, Hare JM. Mesenchymal stem cell-based therapy for cardiovascular disease: progress and challenges. Mol Ther 2018;26:1610–23. https://doi.org/10.1016/j.ymthe.2018.05.009
6. U.S. National Library of Medicine.Database. Available online:(accessed on 27 January 2021)
7. Willis, G.R.; Fernandez-Gonzalez, A.; Anastas, J.; Vitali, S.H.; Liu, X.; Ericsson, M.; Kwong, A.; Mitsialis, S.A.; Kourembanas, S. Mesenchymal Stromal cell exosomes ameliorate experimental bronchopulmonary dysplasia and restore lung function through macrophage immunomodulation. Am. J. Respir. Crit. Care Med. 2018, 197, 104–116. https://doi.org/10.1164/rccm.201705-0925OC
8. Riazifar, M.; Mohammadi, M.R.; Pone, E.J.; Yeri, A.; Lässer, C.; Segaliny, A.I.; McIntyre, L.L.; Shelke, G.V.; Hutchins, E.; Hamamoto, A.; et al. Stem cell-derived exosomes as nanotherapeutics for autoimmune and neurodegenerative disorders. ACS Nano 2019, 13, 6670–6688. https://doi.org/10.1021/acsnano.9b01004
9. Shahir, M.; Hashemi, S.M.; Asadirad, A.; Varhram, M.; Kazempour-Dizaji, M.; Folkerts, G.; Garssen, J.; Adcock, I.M.; Mortaz, E. Effect of mesenchymal stem cell-derived exosomes on the induction of mouse tolerogenic dendritic cells. J. Cell. Physiol. 2020, 235, 7043–7055. https://doi.org/10.1002/jcp.29601
10. He, X.; Dong, Z.; Cao, Y.; Wang, H.; Liu, S.; Liao, L.; Jin, Y.; Yuan, L.; Li, B. MSC-derived exosome promotes M2 polarization and enhances cutaneous wound healing. Stem Cells Int. 2019, 2019, 1–16. https://doi.org/10.1155/2019/7132708
11. Kordelas, L.; Rebmann, V.; Ludwig, A.-K.; Radtke, S.; Ruesing, J.; Doeppner, T.R.; Epple, M.; Horn, P.A.; Beelen, D.W.; Giebel, B. MSC-derived exosomes: A novel tool to treat therapy-refractory graft-versus-host disease. Leukemia 2014, 28, 970–973. https://doi.org/10.1038/leu.2014.41
12. Katsarou, A.; Gudbjörnsdottir, S.; Rawshani, A.; Dabelea, D.; Bonifacio, E.; Anderson, B.J.; Jacobsen, M.L.; Schat, D.A.; Lenmark, A. Type 1 diabetes mellitus. Nat. Rev. Dis. Primers 2017, 3, 1–17. https://doi.org/10.1038/nrdp.2017.16
13. Nojehdehi, S.; Soudi, S.; Hesampour, A.; Rasouli, S.; Soleimani, M.; Hashemi, S.M. Immunomodulatory effects of mesenchymal stem cell–derived exosomes on experimental type-1 autoimmune diabetes. J. Cell. Biochem. 2018, 119, 9433–9443. https://doi.org/10.1002/jcb.27260
14. Shao, L.; Zhang, Y.; Lan, B.; Wang, J.; Zhang, Z.; Zhang, L.; Xiao, P.; Meng, Q.; Geng, Y.J.; Yu, X.Y. MiRNA-sequence indicates that mesenchymal stem cells and ex-osomes have similar mechanism to enhance cardiac repair. BioMed Res. Int. 2017. https://doi.org/10.1155/2017/4150705
15. Ono, M.; Kosaka, N.; Tominaga, N.; Yoshioka, Y.; Takeshita, F.; Takahashi, R.-U.; Yoshida, M.; Tsuda, H.; Tamura, K.; Ochiya, T. Exosomes from bone marrow mesenchymal stem cells contain a microRNA that promotes dormancy in metastatic breast cancer cells. Sci. Signal. 2014, 7, ra63. https://doi.org/10.1126/scisignal.2005231
16. Melzer, C.; Rehn, V.; Yang, Y.; Bähre, H.; Von Der Ohe, J.; Hass, R. Taxol-loaded MSC-derived exosomes provide a therapeutic vehicle to target metastatic breast cancer and other carcinoma cells. Cancers 2019, 11, 798. https://doi.org/10.3390/cancers11060798
17. Taghavi-Farahabadi, M.; Mahmoudi, M.; Soudi, S.; Hashemi, S.M. Hypothesis for the management and treatment of the COVID-19-induced acute respiratory distress syndrome and lung injury using mesenchymal stem cell-derived exosomes. Med. Hypotheses 2020, 144, . https://doi.org/10.1016/j.mehy.2020.
18. Lee BC, Kang I, Yu KR. Therapeutic Features and Updated Clinical Trials of Mesenchymal Stem Cell (MSC)-Derived Exosomes. J Clin Med. 2021 Feb 11;10(4):711. https://doi.org/10.3390/jcm10040711
19. Roig-Rosello, E.; Rousselle, P. The human epidermal basement membrane: A shaped and cell instructive platform that aging
slowly alters. Biomolecules 2020, 10, 1607. https://doi.org/10.3390/biom10121607
20. Kim YJ, Yoo SM, Park HH, Lim HJ, Kim YL, Lee S, Seo KW, Kang KS. Exosomes derived from human umbilical cord blood mesenchymal stem cells stimulates rejuvenation of human skin. Biochem Biophys Res Commun. 2017 Nov 18;493(2):1102-1108.





